北京基因組所(國家生物信息中心)合作揭示RNA m6A甲基化促進SHH亞型髓母細胞瘤進展的重要作用機制
髓母細胞瘤是兒童最常見的惡性腦腫瘤之一,具有WNT、SHH、G3和G4四個分子分型。其中SHH-MB的發生源于hedgehog信號通路持續激活引起小腦顆粒神經元前體細胞過度增殖,由于其內部異質性強、病人預后相差很大等臨床問題,目前尚缺乏有效的靶向治療方法。N6-甲基腺苷(N6- methyladenosine, m6A)是哺乳動物mRNA最常見的表觀轉錄標記,能夠調節RNA出核、降解和翻譯等多個RNA代謝過程,并通過靶向特定信號通路調控神經發育等多個生物學功能。團隊前期研究發現RNA m6A甲基化可調控小鼠小腦顆粒神經元的增殖與分化(Genome Biology, 2018),但RNA m6A甲基化是否參與SHH-MB腫瘤的進展過程還不甚清楚,因此系統開展表觀轉錄組研究對SHH-MB腫瘤診斷及治療具有重要意義。
近日,中國科學院北京基因組研究所(國家生物信息中心)宋述慧團隊與醫學科學院基礎醫學研究所佟偉民教授團隊、北京天壇醫院劉丕楠教授團隊聯合揭示RNA m6A甲基轉移酶METTL3通過調控Sonic hedgehog通路中PTCH1和GLI2 m6A甲基化促進SHH亞型髓母細胞瘤(Sonic hedgehog signaling-medulloblastoma, SHH-MB)進展,并以“METTL3 regulates m6A methylation of PTCH1 and GLI2 in Sonic hedgehog signaling to promote tumor progression in SHH-medulloblastoma” 為題在Cell Reports 正式發表。該研究首次報道了SHH-MB 中,m6A甲基轉移酶METTL3表達升高導致了腫瘤中PTCH1和GLI2 RNA m6A甲基化水平升高,使得hedgehog信號通路過度激活,進而促進了腫瘤的進展。
團隊發現m6A 甲基轉移酶METTL3在SHH-MB中過表達,與預后呈負相關。通過腫瘤組織的m6A-seq發現SHH-MB腫瘤中多個轉錄本的甲基化修飾出現異常,且高甲基化的轉錄本與hedgehog信號通路高度相關。體外實驗證明METTL3通過催化m6A調控髓母細胞瘤細胞的增殖和遷移、促進細胞凋亡。通過敲低METTL3前、后的髓母細胞瘤細胞系進行的m6A-seq及分子水平的研究,發現METTL3的主要作用底物是hedgehog信號通路中的兩個核心因子PTCH1和GLI2,并且通過調控RNA降解和翻譯的方式、干擾抑癌基因PTCH1和原癌基因GLI2的表達,進而造成hedgehog信號通路的持續激活。隨后,通過原位裸鼠成瘤實驗證實,METTL3缺失能夠減緩SHH-MB進展,延長小鼠生存期。同時,利用病人來源的SHH-MB腫瘤原代細胞開展的藥物實驗證明METTL3特異性抑制劑STM2457亦可以有效地殺傷SHH-MB腫瘤細胞。以上結果均提示METTL3有望成為SHH-MB治療的潛在靶點。
該研究首次闡明SHH-MB腫瘤進展的表觀轉錄調控機制,同時證明METTL3具有成為SHH-MB全新治療靶點的潛在可能,為開發相關治療策略提供了重要思路。
該研究得到中科院青年創新促進會、中國醫學科學院醫學與健康科技創新工程等項目的資助。基礎醫學研究所牛亞梅研究員、佟偉民教授,北京天壇醫院劉丕楠教授和中國科學院北京基因組研究所宋述慧研究員為論文共同通訊作者,基礎醫學研究所張至瑋博士、北京基因組研究所滕徐菲博士、北京天壇醫院趙賦副研究員和基礎醫學研究所馬春卉助理研究員為論文的共同第一作者。
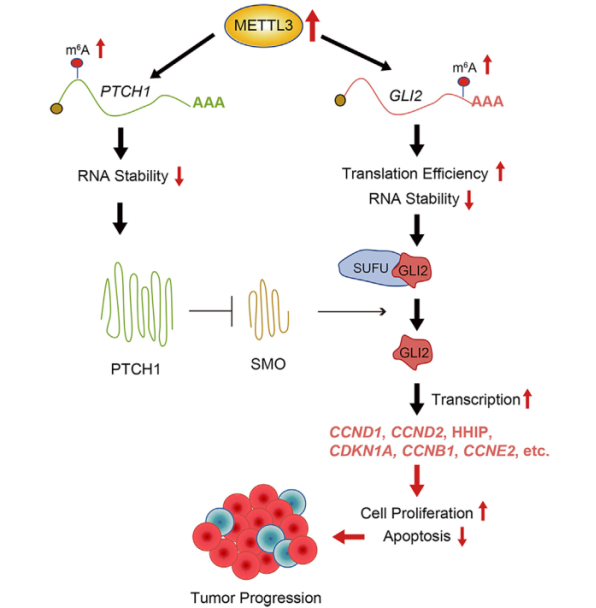
METTL3通過調控PTCH1和GLI2 RNA m6A甲基化促進SHH-MB的發展進程