北京基因組所(國家生物信息中心)合作揭示m6A去甲基化酶FTO調控腫瘤免疫逃逸新機制
CD8+ T細胞是機體識別與殺傷腫瘤細胞的關鍵免疫細胞,其功能卻常常被復雜的腫瘤微環境所抑制。前期研究表明,腫瘤細胞可利用多種表觀修飾機制調節T細胞介導的抗腫瘤免疫應答,從而實現免疫逃逸。而m6A作為一種動態可逆的表觀轉錄組修飾,影響mRNA的穩定性及翻譯等過程,在腫瘤的發生發展中起到重要的作用。然而,腫瘤細胞的m6A修飾如何參與調節腫瘤免疫微環境,調控T細胞介導的免疫監視,目前仍不太清楚。
4月27日,中國科學院北京基因組研究所(國家生物信息中心)韓大力研究組聯合清華大學免疫研究所徐萌團隊、中科院上海藥物研究所楊財廣團隊,在Cell Metabolism 雜志在線發表題為“Tumors exploit FTO-mediated regulation of glycolytic metabolism to evade immune surveillance”的研究論文,揭示了m6A去甲基化酶FTO通過表觀轉錄組調控,增強腫瘤細胞糖酵解代謝,進而抑制T細胞激活和抗腫瘤功能的免疫逃逸新機制。
研究人員發現,在不同實體瘤細胞中敲低m6A的去甲基化酶FTO,均能抑制腫瘤在小鼠體內的生長,并增加腫瘤中浸潤的抗原特異性CD8+ T細胞的比例。進一步的研究表明,在腫瘤中敲低FTO會使CD8+ T細胞更快地激活,更有效地執行殺傷腫瘤細胞的功能。通過對RNA-seq、MeRIP-seq (m6A-seq)、ATAC-seq、ChIP-seq等多維組學測序數據的整合分析發現,FTO可調控多個bZIP家族轉錄因子的m6A修飾,并促進其mRNA穩定性。這些bZIP家族轉錄因子能促進糖酵解基因的表達,增強腫瘤細胞糖酵解活性,進而抑制CD8+ T細胞的激活。基于此,研究者以靶向FTO的小分子抑制劑Dac51為小分子工具,進一步驗證FTO在實體瘤中通過調控腫瘤糖酵解,逃逸免疫監視的機制。隨后,在小鼠模型中分別采用了PD-L1阻斷和Dac51小分子的治療,發現其均能有效抑制腫瘤在小鼠體內生長,而聯合PD-L1和Dac51能大幅提升治療效果。另外,研究者在病人腫瘤樣本建立的類器官模型中也發現,Dac51處理能有效地增強T細胞的抗腫瘤免疫應答,提示了Dac51在臨床應用上的可能性。綜上,研究者提出,m6A去甲基化酶FTO可作為免疫治療的有效靶點,對RNA修飾進行干預將有望成為免疫治療的新策略。
中國科學院北京基因組研究所(國家生物信息中心)韓大力研究員,清華大學醫學院徐萌研究員和中科院上海藥物研究所楊財廣研究員為論文的共同通訊作者。中國科學院北京基因組研究所(國家生物信息中心)碩士生梁廣豪,清華大學博士生劉弋和董文鑫,中科院上海藥物研究所博士生徐洪蛟和董澤博士為共同第一作者。該研究得到了國家重點研發計劃、國自然生物大分子重大研究計劃、中國科學院戰略性先導科技專項等基金資助。
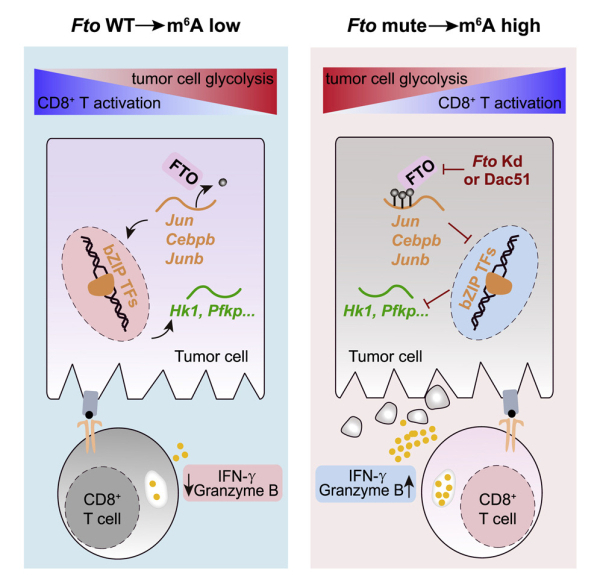
m6A修飾去甲基化酶FTO促進腫瘤糖酵解并限制T細胞免疫應答。使用FTO小分子抑制劑Dac51進行治療可以增加腫瘤內CD8+ T細胞浸潤并與PD-L1阻斷治療產生協同效應






